研究成果
トピックス
- 双極性障害に先天的・後天的デノボ変異がともに関連-双極性障害の病態理解が一歩前進-
- 双極性障害を伴いやすい小胞体カルシウムポンプ遺伝子の病気(ダリエ病)のモデルマウスは行動変化と高ドーパミン状態を引き起こす
双極性障害の確実な原因遺伝子が見つかっていない中で、双極性障害の症状を示すことの多い遺伝子疾患が、原因解明の手がかりになると期待されます。
ダリエ病は、皮膚の病気ですが、1994年に、英国のクラドック博士らは、気分障害とダリエ病が連鎖する家系を発見しました。その後、その原因遺伝子が、細胞内小器官の一つで、カルシウムを貯蔵している「小胞体」にあるカルシウムポンプ(ATP2A2)である、ということがわかり、注目されました。その 頃すでに、双極性障害に細胞内カルシウムシグナルが関係していると考えられていたからです。その後、2014年に報告された統合失調症のゲノムワイド関連研究でも、この遺伝子との関連が指摘されました。
私たちは2016年に、ダリエ病の症例報告を全て確認して、この病気の患者さんのうち、機能障害の強い変異を持つ人では、機能障害の軽い変異を持つ人に 比べ、双極性障害や統合失調症などの精神疾患が多いことを確認し(Nakamuraら2016)、脳の細胞がこの遺伝子(ATP2A2)の機能を失っているマウスを作り、研究を始めました。
このマウスでは、脳の小胞体がカルシウムを取り込む活性が低下しているため、神経細胞の興奮に伴って細胞内のカルシウム濃度が上がった後、下がりに くくなってしまっていることがわかりました。このマウスの行動を調べてみると、新しい環境に対する行動反応が亢進しているという、ドーパミンの活性が高まっていることを示唆する行動変化が見られました。そこで、マウスを新しい環境に移す前後で、脳内のドーパミン量を測ったところ、確かにドーパミンの濃度が高くなっていました。
これらの結果から、このマウスでは、脳で小胞体のカルシウム取り込み能が低下した結果、神経細胞の興奮に伴う細胞内カルシウム上昇が収まりにくくなったために、ドーパミンが過剰に放出されてしまい、行動変化を起こしていると考えられました。双極性障害の躁状態と統合失調症では、いずれもドーパミンが過剰に分泌されていると考えられていますので、このマウスで見られた変化は、この遺伝子が双極性障害と統合失調症の両方と関係しているということと一致していると考えられます。
双極性障害における小胞体のカルシウムシグナル変化が、モノアミン神経伝達物質の一つである「ドーパミン」の変化を引き起こすという今回の研究は、双極性障害の数多ある仮説のうち、「モノアミン仮説」と「カルシウム仮説」を結びつけることで、双極性障害という病気の全体像の理解を少し進めることができたと言えるかも知れません。(加藤忠史・順天堂大学)
Nakajima K, Ishiwata M, Weitemier AZ, Shoji H, Monai H, Miyamoto H,
Yamakawa K, Miyakawa T, McHugh TJ, Kato T*. Brain-specific
heterozygous loss-of-function of ATP2A2, endoplasmic reticulum Ca2+
pump responsible for Darier’s disease, causes behavioral abnormalities
and a hyperdopaminergic state. Human Molecular Genetics (2021 Jun 8) - 双極性障害患者さんの神経細胞におけるDNAメチル化変化とその特徴
双極性障害の発症には、遺伝・環境相互作用が関係していると考えられており、環境要因が、長期的に遺伝子の働きに影響を与える、「エピジェネティクス」と呼ばれる現象も関与しているのではないかと考えられてきました。こうした現象を担うメカニズムの一つが、DNAのメチル化です。しかし、こうした研究には、実際に遺伝子が働く組織(精神疾患の場合は脳)を直接調べる必要があることから、研究がなかなか進みませんでした。さらに、脳はさまざまな種類の細胞が混在しており、各々の細胞種が異なるDNAメチル化状態を示すため、普通に脳組織を解析しただけでは、神経細胞のDNAメチル化を調べることができませんでした。
そこで私たちの研究グループは、米国スタンレー財団より提供を受けた死後脳試料を用い、セルソーターという装置で神経細胞の細胞核だけを選び出し、網羅的なDNAメチル化解析を行いました。双極性障害患者さん34名、健常者35名の前頭葉組織から神経細胞核と非神経細胞核(主にグリア細胞)を取り出して、DNAを抽出して、遺伝子の発現をコントロールしているゲノム領域のDNAメチル化状態を、DNAマイクロアレイを用いて網羅的に調べました。
その結果、神経細胞、非神経細胞共に、健常者と比べ、双極性障害患者さんでは多くの遺伝子が低メチル化状態にあることがわかりました。一方、精神・神経機能に重要な遺伝子については、双極性障害患者さんの神経細胞で高メチル化状態にありました。患者さんではDNAメチル化に関わる酵素(DNMT3B)の遺伝子の発現が上昇しており、これが高メチル化に関係している可能性が考えられました。
次に、ヒト神経系培養細胞を用いて、気分安定薬の影響を調べました。気分安定薬(リチウム、バルプロ酸、カルバマゼピン)存在下でDNAメチル化が変化したゲノム領域は、双極性障害患者さんでDNAメチル化状態の変化が見られた領域との重なりが多く見られ(30%)、変化の方向は逆方向を示すものが多いことから、気分安定薬は、双極性障害患者さんの脳で見られるメチル化変化を、正常な方向に戻す作用を持つと考えられました。
双極性障害患者さんでDNAメチル化状態が変化した領域は、双極性障害に関するゲノムワイド関連解析(GWAS)で、双極性障害との関連が報告されたゲノム領域に多いことがわかったことから、遺伝要因とエピジェネティック変化には関連があることが示唆されました。
このように、双極性障害患者さんの神経細胞におけるDNAメチル化変化と、その特徴が明らかになりました。これによって、双極性障害の病態の理解が進むと期待されます。将来的には、エピジェネティックな状態を標的とした治療薬の開発も期待されます。(加藤忠史・順天堂大学、岩本和也・熊本大学)
Bundo M, Ueda J, Nakachi Y, Kasai K, Kato T, Iwamoto K.
Decreased DNA methylation at promoters and gene-specific neuronal
hypermethylation in the prefrontal cortex of patients with bipolar
disorder. Molecular Psychiatry 2021 (April 20/2021) - 精神疾患に神経細胞のアンバランスな運命付けが関連 -iPS細胞由来脳オルガノイドの研究から-
精神疾患の病態解明が進められていますが、分子・細胞レベルのメカニズムについては、不明な点が多く残り、未だ治療にもつながっていません。
その理由として、患者さんの脳を直接分子・細胞レベルで調べる方法がないこと、遺伝的多様性により、精神疾患の影響を調べるには多数の方を調べる必要があることなどがありました。
今回、私たちは、遺伝的多様性の影響を最小限に抑えるため、1人だけが精神疾患を発症した一卵性双生児に注目しました。一人だけが統合失調感情障害双極型(双極性障害の重症型のような疾患)を発症した一卵性双生児ペアからiPS細胞を樹立し、脳オルガノイドを作製することにより、培養皿上で脳の発達過程を再現しました。そして、脳オルガノイドの細胞を1つ1つばらばらにして、各単一細胞の遺伝子発現解析を行いました。
その結果、患者さん由来の脳オルガノイドでは、健常な双生児の方と比べ、抑制性神経細胞(GABA作動性神経細胞)への分化が亢進していました。そのメカニズムとして、「Wnt(ウイント)シグナル」というシグナル伝達系の機能低下が示唆されました。Wntシグナル経路を活性化させることが知られているリチウムで処理すると、抑制性神経細胞への分化は、健常な双生児と同じレベルになりました。2次元で培養した神経細胞でも、同様の結果が得られました。さらに、統合失調症に関して不一致な2ペアの一卵性双生児でも、患者さんで抑制性神経細胞のマーカーが亢進しているという、同様の結果が確認できました。
これらのことから、統合失調感情障害双極型や統合失調症では、Wntシグナル経路の機能低下により、神経前駆細胞の分化の方向性が変化し、神経回路における興奮性・抑制性神経細胞バランスの不均衡が引き起こされている可能性があることがわかりました。
これまでの研究では、統合失調症や双極性障害の患者さんの死後脳では、むしろ抑制性神経細胞の数が減少していることが報告されていました。これは長い病気の経過と治療の後の所見であり、発症までの間に脳にどのような細胞レベルの変化があるかはわかっていませんでした。今回の研究結果から考えると、死後脳で認められる抑制性神経細胞の減少は、実は神経回路の興奮/抑制バランスを保つための代償性変化の結果なのかも知れません。
この研究は1細胞遺伝子発現解析の精神疾患研究への初の応用例と言っても良く、精神疾患の分子・細胞レベルの病態解明やiPS細胞由来神経細胞を用いた治療法の開発などに貢献すると期待できます。
(澤田知世[現・ジョンズ・ホプキンス大学リーバー脳発達研究所]、加藤忠史[現・順天堂大学医学部精神医学講座])
Sawada T, Chater TE, Sasagawa Y, Yoshimura M, Fujimori-Tonou N, Tanaka K, Benjamin KJM, Paquola ACM, Erwin JA, Goda Y, Nikaido I, Kato T. Developmental excitation-inhibition imbalance underlying psychoses revealed by single-cell analyses of discordant twins-derived cerebral organoids. Molecular Psychiatry (2020年8月7日online)
- 双極性障害と遺伝性腎疾患が連鎖する家系で見出された神経成長因子受容体遺伝子(NTRK1)変異の意義
双極性障害では、一卵性双生児では二卵性双生児にくらべ、2人とも発症する確率が高いことから、ゲノム要因が関係していると考えられています。これまでのゲノム研究で、効果の小さな個人差(多型)との関連や、デノボ変異(両親の持たない、新たに生じた変異)との関連が報告されていますが、大きな家系で、双極性障害と共に伝わっている原因遺伝子変異が特定された事例はほとんどありません。多くの特徴的な身体症状によって診断を特定しやすい遺伝性疾患に比べると、双極性障害の診断が難しいことがその一因と考えられます。明確な身体症状を伴う遺伝性疾患であり、その症状の一部として双極性障害を発症しているような家系であれば、原因遺伝子が特定しやすく、研究が進展すると期待されます。
2012年に、ハンブルクで行われた国際精神科遺伝学会(WCPG)で、カルフォルニア大学サンディエゴ校のKelsoe教授が、双極性障害と遺伝性腎疾患が連鎖する家系で、原因遺伝子をNTRK1と特定した、と発表されました。NTRK1は、神経成長因子(NGF)の受容体の遺伝子です。NGFは、脳の発生に関わっており、特にアセチルコリンという、認知機能や気分との関係も示唆されている神経伝達物質を持つ神経細胞の発生に関わっていることが知られています。ただ、NGFが成体の脳でどんな働きをしているかはまだよくわかっていません。Kelsoe教授は、以前から、アセチルコリンを強める薬がうつ状態を引き起こすことなどから、気分障害におけるアセチルコリンの役割に注目していたため、このNTRK1変異により、アセチルコリン神経が過剰にできてしまい、双極性障害の発症に影響しているのではないかと推測していました。
Kelsoe教授の学会発表を聞いた私は、この知見が双極性障害研究の突破口になるかも知れないと思い、共同研究を申し込みました。先方の研究室で患者さん由来のiPS細胞を作って解析すると共に、私の研究室では、この変異を持つマウスを作成して解析することになりました。この変異は、アミノ酸1つが置き換わった結果、受容体の機能が高まり、NGFが過剰に働く可能性がありましたので、この遺伝子を持たない「ノックアウトマウス」でなく、同じアミノ酸配列を持つマウス(ノックインマウス)を作る必要がありました。しかも、腎疾患も引き起こす可能性があるため、脳だけに変異が生じるマウスを作らねばなりません。(実際はその後、腎疾患の原因は、近くの別の遺伝子の変異であることがわかりました。)
脳特異的なノックインマウスの作成という、これまでほとんど成功したことのない研究に、中島一夫研究員が取り組み、作成に成功しました。このマウスは、アセチルコリンの働きを強める薬の投与後、尾懸垂試験において、抑うつ状態の指標とされる反応(動かない時間が延長する)を示しました。ところが、このマウスでは、アセチルコリン神経は増えていませんでした。しかし、海馬で、アセチルコリンにより活性化されるシグナル系が亢進すると共に、神経細胞の形態が変化し、神経突起が少なくなっていることがわかりました。この変異を持つ患者さんのiPS細胞から作った神経細胞でも、同様に神経突起が少ないという変化が見られました。
これらのことから、この家系においては、NTRK1の変異により、神経細胞において、アセチルコリンなどの神経伝達物質に対するシグナル伝達系が変化することによって、神経細胞の機能が変化することがその原因になっている可能性が考えられました。
当初予想されたメカニズムとは異なっていたことに加え、成体でのNGFの働きがまだよくわかっていないため、残念ながら、この変異が双極性障害において果たす役割について全体像が分かったとは言えません。更なる研究が必要だと思います。(順天堂大学精神医学講座 加藤忠史)
Nakajima K*, Miranda A*, Craig DW, Shekhtman T, Kmoch S, Bleyer A, Szelinger S, Kato T#, Kelsoe JR#.
Ntrk1 mutation co-segregating with bipolar disorder and inherited kidney disease in a multiplex family causes defects in neuronal growth and depression-like behavior in mice.
Transl Psychiatry. 2020 Nov 24;10(1):407.
理研時代の研究成果
トピックス
- 精神疾患に神経細胞のアンバランスな運命付けが関連
- 双極性障害におけるミトコンドリアとセロトニンの関係
- うつ病患者における血漿ミトコンドリアDNAと炎症性サイトカインの関連
双極性障害やうつ病などの気分障害では、インターロイキン6(IL-6)などの、「サイトカイン」と呼ばれる炎症に関わる物質が増加していることが多く報告されており、気分障害のバイオマーカー(検査法)になるのではないかと期待されています。しかしながら、感染症などで上昇するサイトカインが、なぜ気分障害で上昇しているのかは良くわかっておらず、上昇の程度も感染症などに比べると、ごくわずかということもあって、検査法として用いられるには至っていません。
細菌感染の際に、サイトカインが上昇するメカニズムの一つとして、細菌が持つDNAが免疫反応を引き起こす、というものがあります。DNAは、人の体も持っていますが、細菌のDNAは、「メチル化」という化学的な修飾を受けないという特徴があり、メチル化されていないDNAは免疫反応を引き起こすことがわかっています。
私たちの身体の中にも、メチル化を受けないDNAがあります。それはミトコンドリアDNAです。ミトコンドリアは、元々私たちの祖先の細胞に共生するようになった微生物のなごりと考えられていて、そのためか、私たちの細胞が持つミトコンドリアのDNAも、メチル化されていないのです。そして、実際に、ミトコンドリアDNAは炎症を引き起こし、サイトカインを上昇させることが知られていました。私たちは、ミトコンドリアDNAの変異によるミトコンドリア機能障害が気分障害の発症に関係していると考えて研究を進めてきました。
そこで、ミトコンドリア機能障害に伴って細胞外に放出されたミトコンドリアDNAが、炎症反応を引き起こし、サイトカインを上昇させている可能性があるのではないか、と考えてこの研究を行いました。多施設共同研究により収集された、183名(うつ病109名、双極性障害28名、統合失調症17名、対照群29名)の方の血漿を用いて、血漿中のミトコンドリアDNAの濃度と、4つのサイトカインを測定しました。
その結果、うつ病の患者さんでは、予想通り、ミトコンドリアDNAの濃度はIL-4、IL-2、GM-CSFという、3つのサイトカインと正の相関を示しました。IL-4については、別の方法でも測定し、相関を確認しました。しかしながら、予想に反し、血漿中のミトコンドリアDNAの濃度は、うつ病、双極性障害では、有意に低い値を示しました。血漿中のミトコンドリアDNA濃度は、筋肉の量や運動の量に影響されるとの報告があるため、こうした因子が影響しているのかも知れません。
また、今回測定した気分障害の患者さん達は、これまでの報告のように、高いサイトカイン値を示さなかったため、今回の研究では、気分障害で見られるサイトカイン高値の原因がミトコンドリアDNAのせいなのかどうか、結論することが出来ませんでした。
気分障害の患者さんにおけるサイトカイン上昇のメカニズムを明らかにするには、もう少し研究が必要なようです。Kageyama Y, Kasahara T, Kato M, Sakai S, Deguchi Y, Tani M, Kuroda K,Hattori
K, Yoshida S, Goto Y, Kinoshita T, Inoue K, Kato T. The relationship between
circulating mitochondrial DNA and inflammatory cytokines in patients with
major depression. J Affect Disord. 2017 Jun 6 - うつ病と双極性障害の鑑別のための血液バイオマーカー候補の同定
うつ病と双極性障害の鑑別はしばしば困難を伴います。その理由は、精神疾患の診断がもっぱら主観的な症状の評価に基づいて行われ、うつ病と双極性障害の症状が類似しているためです。これらの疾患に用いる治療薬はそれぞれ種類が異なるため、診断の補助となる客観的な指標
(バイオマーカー) が適切な治療のために強く望まれています。近年、メタボローム解析と呼ばれる分析法がバイオマーカーの探索に用いられるようになりました。これは、血液や脳脊髄液などの中に存在する代謝物質を一網打尽に分析する方法です。
今回の研究では、薬を服用していないうつ病患者さん9名、双極性障害患者さん6名、統合失調症患者さん17名、および健常者19名の血液中代謝産物を液体クロマトグラフィー/飛行時間型質量分析計により網羅的に測定し、
うつ病と双極性障害を区別できるバイオマーカーの候補を探しました。
その結果、176種類の代謝産物を検出し、不飽和脂肪酸の1種であるネルボン酸が候補として上がりました。半数以上の検体で測定限界未満だったため、ガスクロマトグラフィー/飛行時間型質量分析器という、別の方法で高精度に測定しなおした結果、うつ病群では、双極性障害群および健常者群よりも、血漿ネルボン酸濃度が高値でした。この結果を別の患者さん由来サンプル群で確認するため、服薬治療中のうつ病患者さん45名、双極性障害患者さん71名、統合失調症患者さん115名、および健常者90名
(第2群)で血漿ネルボン酸濃度を測定したところ、
やはりうつ病群では双極性障害群および健常者群より血漿ネルボン酸濃度が高く、統合失調症群よりも高値でした。
第2群で細かく検討したところ、うつ病患者さんのうつ状態では、うつ病患者さんの寛解期や、双極性障害患者さんのうつ状態よりも、有意に血漿ネルボン酸濃度が高値でした。今回の結果から、血漿ネルボン酸濃度が、うつ病と双極性障害を区別する補助に用いることができる可能性が示唆されました。
ネルボン酸は脳の白質に多く、神経線維を取り巻く髄鞘(ミエリン)に多く含まれています。うつ病患者さんのMRIでは、脳の白質にダメージがみられる場合があるので、血漿ネルボン酸が高いことは、ひょっとして白質の障害を反映しているのかも知れません。
しかし、血液中の物質は、年齢、性別、内服薬の種類、食事内容、採血時間、既往歴などの影響を受ける可能性があります。今後、臨床へ応用するためには、さらに多くの患者さんの検体で測定を行い、有用性を検討する必要があります。Kageyama Y, Kasahara T, Nakamura T, Hattori K, Deguchi Y, Tani M, Kuroda
K, Yoshida S, Goto Y, Inoue K, Kato T. Plasma nervonic acid is a
potential biomarker for major depressive disorder: a pilot study.
International Journal of Neuropsycho pharmacology, 2017 Oct 6. - 双極性障害の患者さんから見つかったミトコンドリアDNA合成酵素遺伝子の変異は酵素機能を低下させるタイプが多い
ヒトゲノムは4種類の塩基が文字のように約30億ならんだものですが、日本人同士のゲノムを比較すると、おそらく1,000文字に1個ぐらいの頻度でゲノム配列に違いがあります。人種が異なれば、もう少し違いが多いかもしれません。これらの違いの多くは良い影響も悪い影響もありませんが、ときには作られるタンパク質の機能の低下や喪失を引き起こすものがあります。私たちは、そのような違いが、双極性障害を含めてさまざまな病気の原因や罹りやすさに関連しているだろうと考えて研究を進めています。(ちなみに、ゲノム配列のまれな違いは、タンパク質への影響には関係なく、「変異」と呼びます。)
今回、私たちは、日本人の双極性障害患者さんと健常者のPOLG1(ポルジーワン)という遺伝子を徹底的に調べ、変異を探しました。POLG1に注目したのには理由があります。POLG1遺伝子はミトコンドリアのDNA合成酵素を作る情報を担っていますが、POLG1の傷害変異は、ミトコンドリア病の一種である慢性進行性外眼筋麻痺という病気を引き起こします。ミトコンドリア病の患者さんの2割弱が双極性障害を発症するのです。さらに、POLG1の傷害変異を持つマウスを作製したところ、うつ病エピソードを繰り返し、リチウムに反応することを私たちは見出したからです。
日本人の双極性障害患者さん796名および健常者767名からPOLG1の変異を探すと共に、東日本大震災の復興プロジェクトの一環として解析された東北メディカル・メガバンクの健常者1,070名のゲノムデータを解析したところ、患者さんからも健常者からもほぼ同頻度(約3%)で変異が見つかりました。これらの変異が傷害変異かどうか(=ミトコンドリアDNA合成酵素の活性を低下させるかどうか)を、3つの異なる手法で細かく解析しました。一つ目は、コンピューターによる予測プログラムを用いる方法です。見つかった変異の傷害の程度を計算したところ、傷害変異と予測された変異が患者さんで多いという結果でした。二つ目の方法は、生化学的な実験です。各変異を含んだPOLG1タンパク質を試験管内で作り、DNA合成酵素の活性を測ったところ、この方法でも、患者さんから見つかった変異には活性を低下させるものが多いという結果でした。三つ目は個体レベルで傷害変異かどうかを推測する方法です。慢性進行性外眼筋麻痺の患者さんで見つかった変異であれば傷害変異だろうと考え、既報のこのような変異を検索したところ、健常者からは一つも見つからず、3名の双極性障害の患者さんが持っており、これは統計学的に有意な違いでした。
以上の結果から、双極性障害の患者さんが持っているPOLG1の変異には、傷害変異が多いことが判明しました。しかし患者さん一人ひとりに注目すると、こうした変異を持つ人は少数で、また、傷害変異を持つ患者さんのご家族で、同じ変異を持っている方でも、双極性障害を持っているとは限りませんでした。このように、こうした傷害変異に関してまだまだ謎は多く、病気の罹りやすさにどのように関わっているのか、他の遺伝子、さらにはゲノム全体の傷害変異はどうなっているのかなど、研究すべきことは山積みです。
- メタボローム解析による服薬していない双極性障害および統合失調症患者さんにおける血漿バイオマーカーの探索
主要な精神疾患である双極性障害では、適切な動物モデルがないために、新しい気分安定薬の開発が進んでいません。私たちは、磁気共鳴スペクトロスコピーによる双極性障害患者さんの測定結果から、双極性障害のミトコンドリア機能障害仮説を提唱し、この仮説に基づいて双極性障害の神経生物学について研究を始めました。
その後、ミトコンドリア病の患者さんでは双極性障害が多いことが報告されています。私達は、ミトコンドリア病の原因の一つである、「ミトコンドリアDNA(mtDNA)欠失」が、患者さんの死後脳でも増加していることを報告しました。その後、双極性障害患者さんの脳における乳酸の上昇やミトコンドリア関連遺伝子の変化、脳脊髄液におけるミトコンドリア関連代謝の変化、細胞におけるミトコンドリア形態の変化、患者さんのiPS細胞由来神経細胞におけるミトコンドリアの変化など、さまざまなデータが報告されています。
双極性障害では、元々、細胞内カルシウム濃度の調節が変化していると言われていましたが、私達は、mtDNAの多型や欠失が、細胞内カルシウムの調節に影響を与えることを報告しました。少なくとも一部の患者さんにおいては、mtDNAの欠失が、細胞内カルシウム制御に影響することを介して、病態生理学的な意義を持つ可能性が考えられます。
脳にmtDNA欠失が蓄積する、ミトコンドリアDNA合成酵素(Polg)の遺伝子改変マウスは、自発性・反復性のうつ病様エピソードを示し、このエピソードは、選択的セロトニン取り込み阻害薬により予防される一方、リチウムの中断により増加しました。この動物モデルは、新たな気分安定薬の開発に有用と考えられました。このマウスを用いた研究により、視床室傍核のミトコンドリア機能障害が、うつ病様エピソードと関連すると考えられました。
私達は既に、このモデルマウスを用いて、新たな薬物の標的分子の探索を始めていますが、双極性障害のよりよい治療のためには、さらなる研究が必要です。
Kato T: Neurobiological basis of bipolar disorder: Mitochondrialdysfunction
hypothesis and beyond. Schizophr Res. 2016 Nov 10. - 統合失調症の新たな遺伝的メカニズムを解明-遺伝子産物の「切り出し」に影響するDNA多型のビッグデータ解析から-
- 双極性障害にデノボ点変異が関与
- ATP2A2の機能喪失変異と双極性障害・統合失調症~症例報告と文献調査
双極性障害の原因遺伝子が未だ解明されていない中で、動物モデル研究を進めるためには、身体疾患の一症状として双極性障害を呈する病気は手がかりとなります。1994年、英国のクラドックらは、ダリエ病という遺伝性角化症と双極性障害が連鎖する家系を報告しました。当初、この皮膚病の原因遺伝子と双極性障害の原因遺伝子が近くにあると推測されましたが、その後、ダリエ病の原因遺伝子が、細胞内小器官である小胞体のカルシウムポンプをコードする遺伝子、ATP2A2であることがわかると、双極性障害のカルシウムシグナリング仮説と合わせて、この遺伝子の多面的な効果によって、皮膚病と双極性障害が起きると考えられるようになりました。最近になって、4万人近くの統合失調症患者さんにおけるゲノムワイド関連研究で、ATP2A2との関連が指摘され、再び双極性障害および統合失調症とATP2A2との関連が注目されています。
今回、日本の双極性障害とダリエ病を伴う患者さんで、その原因を探るためシーケンス解析を行ったところ、ATP2A2の蛋白質をコードする部分(エクソン)の近傍にあるイントロン(蛋白質をコードしていない部分)に、まれな変異を発見しました。この変異がスプライシング(イントロンを取り除き、エクソンのみを選択してつなげていく過程)に関係している可能性を考え、ゲノムのこの部分をヒト細胞に組み込み、どんなRNAが作られるか調べました。その結果、この変異がスプライシング異常を起こし、正しい蛋白質が作られなくなることがわかりました。
ダリエ病では、さまざまなアミノ酸置換を伴う原因変異が報告されており、このように機能を失う変異はまれです。そこで、こうした機能喪失型変異と双極性障害・統合失調症の関連を調べるため、ダリエ病の症例報告論文を全て確認しました。その結果、双極性障害・統合失調症などを伴う症例で報告されている変異は、それ以外の変異に比べ、有意に機能喪失型変異が多いことがわかりました。この結果は、ダリエ病に伴う双極性障害や統合失調症が、ATP2A2変異の多面的効果によるものであることを示しています。今回の結果は、脳特異的なATP2A2のヘテロ欠損マウスが、双極性障害のモデルマウスになりうる可能性を示していると言えるでしょう。
Nakamura T, Kazuno A, Nakajima K, Kusumi, I, Tsuboi T, Kato T. Loss of
function mutations in ATP2A2 and psychoses: A case report and literature
survey. Psychiatry and Clinical Neurosciences, Apr 23/2016, online - 自発的なうつ状態を繰り返す初めてのモデルマウス ―うつ病の新たな候補脳部位を同定―
- 「RNA編集」と精神疾患
「RNA編集」というのは、全く聞きなれない言葉だと思いますので、まずこの言葉からご説明しましょう。両親から半分ずつ受け継ぎ、からだを作る設計図となっているのが、「DNA」という物質です。蛋白質を作ったりするために、このDNAに含まれる遺伝情報をコピーして作られる物質は、RNAです。RNAは一時的に使われるものなので、DNAよりはるかに不安定で分解されやすい物質です。蛋白質は、アミノ酸が多数つながった物質で、3文字のDNA/RNAで1つアミノ酸が決まります。蛋白質を作るなら、設計図通りに作らないと意味がないように思えますが、実は設計図であるDNAの配列と異なった蛋白質が作られる場合があります。これは、一旦DNAからコピーされて作られたRNAが、ADARという酵素によって化学的に変化し、配列が変わってしまうために起こります。なぜ生物が進化の中でこのような現象を獲得したのかは、完全には分かっていません。
さて、ヒトでこのRNA編集を受ける遺伝子として、最も早くから知られていたのが、セロトニン受容体とグルタミン酸受容体です。セロトニンとグルタミン酸は、いずれも神経伝達物質で、精神疾患との関係が推測されています。(なお、グルタミン酸受容体にはNMDA型などいくつか種類があり、RNA編集を受けるのはAMPA型と呼ばれるタイプです。)
そこで私たちは、精神疾患とRNA編集の関係を調べるため、双極性障害および統合失調症の患者さんの脳組織で、RNA編集酵素(ADAR2)の発現量(RNAの量)を調べました。その結果、双極性障害および統合失調症の患者さんの脳では、ADAR2の発現量が減っており、ADAR2が低下している人ほど、グルタミン酸受容体のRNA編集が少ないことがわかりました。
そこで、ADAR2遺伝子を1つ失っている遺伝子改変マウスを調べることにしました。このマウスでも、やはりグルタミン酸受容体のRNA編集が低下していました。このマウスは、精神刺激薬であるアンフェタミンに対して強く反応し、行動量が増えすぎてしまうなどの行動変化が見られました。しかし、AMPA型グルタミン酸受容体を阻害する薬を事前に投与しておくと、こうした違いはなくなりました。このことから、このマウスの行動変化は、おそらくAMPA型グルタミン酸受容体のRNA編集の変化を介しているのだろうと考えられました。
マウスの研究だけでは、本当に精神疾患と関係あるかどうかわからないため、患者さんの脳組織の研究が必要ですが、患者さんの脳組織の研究だけで病気のメカニズムを解明することもまた困難です。そのため、患者さんの脳組織の研究と、動物モデルの研究を組み合わせて精神疾患の解明を進めることが大切です。
今回の、患者さんの脳組織の研究と遺伝子改変マウスの研究の結果から、グルタミン酸受容体のRNA編集の変化が精神疾患の病態に関係している可能性が考えられました。
Kubota-Sakashita M, Iwamoto K, Bundo M, Kato T (2014) A role of ADAR2 and RNA
editing of glutamate receptors in mood disorders and schizophrenia.
Molecular Brain, 7:5 - レトロトランスポゾン
統合失調症患者の神経細胞でレトロトランスポゾン配列が増大
統合失調症はおよそ100人に1人が発症し、幻聴、妄想などの陽性症状、意欲低下などの陰性症状、認知機能障害などが出現し、社会生活が障害される精神疾患です。統合失調症の発症メカニズムには、遺伝因子および環境因子の相互作用による脳発達の障害が関係していると考えられていますが、その詳細なメカニズムはわかっていませんでした。
今回、東京大学大学院医学系研究科分子精神医学講座(岩本和也特任准教授、文東美紀特任助教)と理化学研究所脳科学センター精神疾患動態研究チーム(加藤忠史チームリーダー)は、多施設共同研究(理研脳センター分子精神医学研究チーム、東京大学精神科、慶應義塾大学、新潟大学、奈良県立医科大学)によって、脳の発達中に、神経細胞のゲノムの中で、LINE-1(ラインワン)と呼ばれるレトロトランスポゾンが増えることが、統合失調症の病態に関わることを明らかにしました。
この成果は、統合失調症の病態の理解に大きな手がかりを与えるとともに、統合失調症の治療法、診断法や発症予防法の開発に寄与すると期待されます。
本研究は、米国の科学雑誌ニューロン(2014年1月22日)に掲載されました。
研究の背景
統合失調症はおよそ100人に1人が発症し、幻聴、妄想などの陽性症状、意欲低下などの陰性症状、認知機能障害などが出現し、社会生活が障害される精神疾患です。統合失調症の発症メカニズムには、遺伝因子および環境因子の相互作用による脳発達の障害が関係していると考えられていますが、その詳細なメカニズムはわかっていません。
2001年に終了したヒトゲノムプロジェクトにより、ヒトゲノムのおよそ半分が一見無意味な反復配列であることが判明し、ゲノムの約6分の1を占める主な反復配列は、LINE-1(ラインワン)と呼ばれています。LINE-1は、ゲノムDNAがRNAに転写された後、逆転写により再びDNAとなり、ゲノムの他の部分を壊して入り込む、レトロトランスポゾンと呼ばれる転移因子です。LINE-1がヒトゲノムの多くを占めるのは進化の結果であり、これが実際に転移することはほとんどないと考えられていました。しかし、2009年に米国のグループが、ヒトの脳が発達する過程において神経前駆細胞でこのLINE-1が活性化し、ゲノムの他の領域に転移する現象を初めて確認しました。
研究の内容
私たちは、統合失調症の病態にLINE-1が関係している可能性を考え、患者の脳組織におけるDNA中のLINE-1配列の含量を測定したところ、健常な対照群と比較してLINE-1配列が統計学的に有意に増加していることを見出しました。また、別の患者群の脳組織を用いた場合でもLINE-1配列の増加が認められ、この増加は、神経細胞で生じていることがわかりました。
次に統合失調症の危険因子である発達期の環境因子(胎生期のウイルス感染や周産期障害)をシミュレーションした動物モデルを用いて検討したところ、これらの環境因子によって、LINE-1配列が増加することがわかりました。また、統合失調症の最も確実な遺伝因子として、染色体異常[22番染色体の欠失]が知られています。このような染色体異常を持つ統合失調症患者から作成したiPS細胞を用いて調べたところ、患者由来のiPS細胞から誘導した神経細胞では、LINE-1配列が増加していることを見出しました。
さらに、統合失調症患者群および対照群の脳組織の全ゲノム解析を行ったところ、患者群では、シナプス(神経細胞の接合部位で、神経細胞同士が連絡する場所)で働く遺伝子や統合失調症の発症に関与していることが疑われている遺伝子の近くに、LINE-1が多く転移していることがわかりました。
これらの結果は、環境因子および遺伝因子の双方によってレトロトランスポゾンLINE-1が転移し、神経活動に関わる遺伝子の働きに影響を与えることが、統合失調症の発症や病態に関与していることを示しています。
本研究の成果は、統合失調症の病態の理解に大きな手がかりを与えるとともに、統合失調症の治療法、診断法や発症予防法の開発に寄与すると期待されます。
論文
Bundo M, Toyoshima M, Okada Y, Akamatsu W, Ueda J, Nemoto-Miyauchi T, Sunaga
F, Toritsuka M, Ikawa D, Kakita A, Kato M, Kasai K, Kishimoto T, Nawa H,
Okano H, Yoshikawa T, Kato T*, Iwamoto K*: (* corresponding authors)
“Increased L1 Retrotransposition in the Neuronal Genome in Schizophrenia”
Neuron,81: 306-313 (2014) - CNV
コピー数変異はどのようにして精神疾患のリスクに影響するのか
10年ほど前まで、ヒトのゲノム(1人の人が持っている遺伝子の一揃い)を調べる方法は、顕微鏡で染色体を観察するか、細胞から取り出したDNAという物質の化学反応を通してその配列を調べるか、という両極端な方法しかありませんでした。DNAは長い分子で、その塩基配列が遺伝情報を持っていますが、顕微鏡で観察できるのは数百万塩基以上にわたってDNAがなくなっていたり(欠失)、増えていたり(重複)する現象です。一方、化学反応で調べられるのは、数百塩基の単位でした。
DNAマイクロアレイという、ゲノムDNAの一部をガラス板に貼り付け、ここに調べたいサンプルに蛍光色素をつけて、これを顕微鏡で見ることによって、数千~数百万塩基の、これまで調べられなかった大きさのゲノムDNAの変化が調べられるようになりました。このマイクロアレイ技術を使って、人のゲノムには、一塩基だけに個人差がある一塩基多型(SNP、スニップ)だけでなく、コピー数変異(CNV)という、多数の遺伝子を含む、数万塩基の配列がごそっと増えたり減ったりしている個人差が多数存在することが、2004年に発見されました。これは、私たちの「ゲノム」「遺伝子」に対する考え方を大きく変える発見でした。つまり、ゲノムの個人差は、予想外に大きかったということです。
さっそく、このCNVが精神疾患で調べられ、自閉症や統合失調症では、1番染色体、15番染色体などのまれなCNVがその危険因子になっていることがわかりました。これは、病気へのかかりやすさを10倍くらいに増やすという、これまでに発見された遺伝要因と比べて、桁違いに大きな影響を持つものでした。ただし、この異常をもっている統合失調症の患者さんは、全患者さんの1パーセント未満であり、数千人を調べた結果、初めてこのことがわかったのです。しかしながら、CNVが病気を起こす場合もある一方で、同じようなCNVが個人差として存在している場合もある訳です。どうしてCNVが病気を起こしたり、起こさなかったりするのかは、よくわかっていませんでした。
そこで私たちは、CNVが脳の遺伝子発現(タンパク質を作ったりするために、DNAの配列が読み取られること)に与える影響を調べました。
72人の亡くなった方の脳(うち23名は双極性障害、23名は統合失調症、そして26名は精神疾患のない方です)で、DNAマイクロアレイを使ってCNVを調べ、遺伝子発現の結果と比較しました。その結果、293か所のCNVが遺伝子発現に影響していました。遺伝子発現に影響するCNVは、頻度の低いものが多く、遺伝子(蛋白質の配列を決めている部分)と重なっている場合が多いことがわかりました。患者さんの持つCNVと重なっている遺伝子には、グルタチオン代謝および酸化ストレスに関係するものが多く見られました(グルタチオンとは、抗酸化作用を持ち、細胞を活性酸素などから守る働きをしている分子です)。遺伝子発現に影響するCNVのうちおよそ4分の1は、精神疾患との関連が報告されているCNVの領域でした。
これらの結果は、遺伝子発現に影響を与えやすいのは、まれなCNVであり、こうしたCNVは、脳の遺伝子発現に影響を与えた結果、病気のリスクを高めると考えられました。
Mehta D, Iwamoto K, Ueda J, Bundo M, Adati N, Kojima T, Kato T.
Comprehensive survey of CNVs influencing gene expression in the human
brain and its implications for pathophysiology. Neuroscience
Research,79: 22-33 (2014) - 双極性障害のバイオマーカー探索
双極性障害は、躁状態、うつ状態を繰り返す疾患です。双極性障害のうつ状態の場合、うつ病と異なり、抗うつ薬により悪化する可能性があるなど、薬物選択が異なってきますので、早期に診断して、適切な治療を開始することが望まれます。しかし、残念ながら、現状では、初発のうつ状態で、双極性障害かどうかを診断する方法がありません。そのため、双極性障害を診断することのできる検査法(バイオマーカー)の開発が必要です。
私たちはこれまで、一卵性双生児で、一人だけが双極性障害を発症した方々を比較することによって、病気に関連した物質をつきとめることができるのでは、と考え、研究を行ってきました。これまで、血液由来細胞でどのような遺伝子が働いているかの解析や、ゲノムの化学的な修飾状態(DNAメチル化)の網羅的な解析により、双極性障害関連分子の同定を目指してきました。
今回は、双極性障害に関して不一致な一卵性双生児の方々で、血液由来細胞(培養リンパ芽球様細胞)の解析により、バイオマーカーの候補となる分子を探索しました。今回用いた方法は、「プロテオミクス」と呼ばれるものです。プロテインは蛋白質のことで、オミクスというのは、全てを調べる方法、という意味です。すなわち、全ての蛋白質を調べる方法が、プロテオミクスです。
血液由来細胞から、蛋白質を抽出し、2次元ディファレンシャルゲル電気泳動という方法を行いました。まずは細長いゲルで蛋白質を電気的な性質により分離し、次に、この細長いゲルを横にして、更に、分子量の大きさによって展開することにより、蛋白質を2次元に展開するのです。このことにより、多数の蛋白質を分離することができ、どこかに特徴的な違いがあれば、それを観察することができるようになります。
その結果、3200のスポットが観察され、そのうち、200の蛋白スポットの信号の強さが、2人の間で異なっていました。これらのスポットより、高速液体クロマトグラフィー・タンデム質量分析という方法により、蛋白質を同定しました。4回の実験を繰り返し、2回以上同定された53個の蛋白質について、どのような蛋白質が多いのかを検討した結果、細胞死、および解糖系(ブドウ糖を代謝する経路)に関連した蛋白質の変化が大きいことがわかりました。
これらの蛋白質が双極性障害のバイオマーカーとなりうるかどうかを検討するため、ウェスタンブロット解析により測定可能であった7つの蛋白質について、双極I型障害患者8名および年齢のマッチした対照群8名という、わずかなサンプルですが、培養リンパ芽球様細胞を用いて検討しました。
その結果、解糖系に関わる蛋白質である、PGAM1(phosphoglycerate mutase 1)が、双極性障害患者で有意に増加していました。
PGAM1は、3-phosphoglycerate
を2-phosphoglycerateに変換する解糖系の酵素です。以前にも、双極性障害患者の脳組織を用いた研究で、PGAM1を含む解糖系の蛋白質の変化が指摘されています。本研究では、治療薬の影響を除外するため、培養リンパ芽球様細胞を用いましたが、培養リンパ芽球様細胞の樹立には1ヶ月程度を要するため、実際の検査においては、血液等、より得やすい試料を用いることが望ましく、今後、他の試料における測定も検討する必要があります。また、治療薬の影響についても検討しなければなりません。
また、今回は8例とわずかな症例数での予備的な検討にとどまってしまいましたが、これは、ウェスタンブロットという、煩雑な方法を用いたためです。症例数を増やした検討のためには、より簡便なELISA等による測定法の開発が必要ですが、今回は、ELISA法で測定を試みたものの、残念ながら、十分な感度での測定が行えませんでした。
いずれにせよ、バイオマーカーとして確立するには、より簡便な方法を開発し、より大きなサンプル数で検討することが必要なことは言うまでもありません。
Kazuno A, Ohtawa K, Otsuki K, Usui M, Sugawara H, Okazaki Y, Kato T.
Proteomic analysis of lymphoblastoid cells derived from monozygotic twins
discordant for bipolar disorder: A preliminary study. PLoS ONE
2013;8(2):e53855 - セロトニントランスポーター
一卵性双生児双極性障害不一致例の網羅的解析によって同定された、双極性障害におけるセロトニントランスポーター遺伝子の高メチル化
1. 一卵性双生児に注目した理由
双極性障害は、一卵性双生児であれば、多くの場合2人とも発症することなどから、遺伝的要因が関与していると考えられています。しかし、まれながら、一卵性双生児で、一人だけが双極性障害にかかっていて、もう一人は何の精神疾患にもかかっていない、という場合もあります。遺伝的に全く同じはずの一卵性双生児で、こうした不一致が生じる場合があることから、双極性障害の発症には遺伝的要因のほか、環境要因や「エピジェネティクス」が関与しているのではないかと考えられています。
2. エピジェネティクスとは何か
親から子どもへと伝わる遺伝情報は、DNAの塩基配列が担っています。エピジェネティクスとは、DNAの塩基配列は変わらないのに、DNAの化学的な状態が変化することによって遺伝子の働きが変化し、これが細胞から細胞へと伝わっていく現象のことを言います。
エピジェネティクスという仕組みにかかわる、代表的な現象が、「DNAのメチル化」です。(細かい説明は※1へ)
3. 今回の研究 ~一卵性双生児の間の違いの発見
一卵性双生児では、DNA配列は同じと思われますが、DNAメチル化は、環境の影響を受け、しかも遺伝子の働きを変化させうることから、一卵性双生児における不一致の原因の1つとして、DNAメチル化に違いがあるのではないかと考えられています。
そこで私たちは、お一人だけが双極性障害にかかっている、二組の一卵性双生児の方々からご提供頂いた、血液由来のDNAを用いて、ゲノム全域で、プロモーター領域におけるDNAメチル化の状態を調べました。「DNAマイクロアレイ」と呼ばれる方法を用いて、ゲノム全体のプロモーターをくまなく調べました。
双生児間でDNAメチル化に差が見られた領域を詳しく調べた結果、一卵性双生児の間で確実にメチル化が違う部分は、一つに絞られました。二組のうち一組では、双極性障害を持つ双生児の方だけで、セロトニントランスポーター遺伝子がメチル化されていることがわかったのです。
4. セロトニントランスポーターとは
セロトニントランスポーターは、抗うつ薬が作用する分子としてよく知られています。
セロトニンという神経伝達物質は、シナプスに出て作用した後、再び細胞に取り込まれて、不活性化されます。この時、細胞への取り込みにかかわるのがセロトニントランスポーターです。この分子の働きを止めるのが抗うつ薬で、それによってシナプスのセロトニン濃度を高めることがその作用に関わると考えられています。
セロトニントランスポーター遺伝子のプロモーター領域に存在するDNA配列の個人差(HTTLPR多型)は、遺伝子の働きと関係していて、ヒトのゲノムの中にあるDNA配列の個人差として、最も有名なものの一つです(※2)。
5. 双極性障害におけるセロトニントランスポーター遺伝子の高メチル化
そこで、私たちは、双極性障害患者さん、および健康な方、それぞれ20名の血液由来DNA(3)を用いて、セロトニントランスポーター遺伝子のDNAメチル化状態を調べるとともに、HTTLPR多型と遺伝子の「発現量」(DNAからコピーされてできたRNAの量のこと)を調べました。
その結果、最初の一卵性双生児の方々と同じように、双極性障害患者さんでは、セロトニントランスポーターが高メチル化状態にあることがわかりました。さらに、HTTLPR多型でS/S型を持つ方だけで、遺伝子発現量がメチル化状態と関連していて、双極性障害患者さんで発現量が低いことがわかりました。
更に、亡くなった双極性障害患者さんと双極性障害でない方の死後脳由来のDNAを用いて、セロトニントランスポーター遺伝子のDNAメチル化状態を調べたところ、これまでの結果と同様、双極性障害患者における高メチル化が確認されました。
6. 結果の意味
これまで、双極性障害やうつ病で、さまざまな形でセロトニントランスポーターが調べられてきました。これは、抗うつ薬がセロトニントランスポーターに作用するから、という理由で、特にこの分子を調べてきた訳です。
ところが、今回の研究は、こうしたこれまでの研究とは異なり、一卵性双生児の方々で、仮説に基づかずに、ゲノム全域を対象とした、網羅的な解析によって、セロトニントランスポーターという、有力な分子が現れてきたのです。
双極性障害の患者さんで見られたセロトニントランスポーター遺伝子の高メチル化は、HTLLPR多型でS型の人に見られました。これまでの研究でも、セロトニントランスポーター遺伝子のDNAメチル化は、小さい頃の環境に影響を受けるのではないか、と報告されています。今回の結果は、遺伝子と環境の相互作用によって、セロトニントランスポーター遺伝子のメチル化状態が変化し、最終的に双極性障害の発症に関与する、という可能性を示すものです。今後は、モデルマウスを用いて、セロトニントランスポーター遺伝子の高メチル化と双極性障害の因果関係を検討したり、セロトニントランスポーターの高メチル化が双極性障害の検査として使えるかどうかを、より多くの患者さんで調べていくといった検討を行っていく必要があります。
Sugawara H, Iwamoto K, Bundo M, Ueda J, Miyauchi T, Komori A, Kazuno A, Adati
N , Kusumi I, Okazaki Y, Ishigooka J, Kojima T, Kato T. Hypermethylation of
serotonin transporter gene in bipolar disorder detected by epigenome
analysis of discordant monozygotic twins. Translational Psychiatry 1: e24,
2011
http://www.nature.com/tp/journal/v1/n7/pdf/tp201126a.pdf※1 DNAメチル化とは
DNAの遺伝情報は、C(シトシン)、G(グアニン)、A(アデニン)、T(チミン)、という4種類の塩基の並びによって表現されています。ところが、このうち「シトシン」は
、2種類の化学的状態があります。すなわち、「シトシン」と「メチル化シトシン」です。
「シトシン」と「メチル化シトシン」は、遺伝情報という意味では、全く違いがありません。しかし、遺伝子の働き方に違いが出てきます。そのため、メチル化シトシンは「5つ目の塩基」と呼ばれたりします。
このメチル化シトシンですが、これはどんなシトシンにも起きる訳ではありません。シトシン(C)の次にG(グアニン)が来た場合、すなわち「CG配列」の時だけ、C(シトシン)にメチル基がついて、「メチル化シトシン」になります(1)。ヒトのゲノム(1つの細胞が持つ、遺伝情報を担うDNAのセット)の中には、CG配列がぱらぱらと散らばっていて、実はそのほとんどがメチル化されています。
さて、ゲノムの中には、CG配列がずらっと並んでいるところがあります。こうした領域は、ゲノムを大海に見立てると、まるで島のように点在しているので、CpGアイランド(島)と呼ばれます(2)。このCpGアイランドは、ゲノムの中で、適当に散らばっている訳ではありません。遺伝子の働きをコントロールする場所(プロモーター)に多く存在するのです。そして、このCpGアイランドのCpG配列では、多くの場合、シトシンはメチル化されていません。※2 HTTLPR多型とは
HTTLPR多型は、うつ病と関係しているのではないか、と疑われて、大変よく研究されています。
特に、S型という、セロトニントランスポーターが作られにくいタイプは、神経質な性格と関係していて、ストレスなどの環境要因でうつ病になりやすくなるのではないか、と考えられています。
ただし、HTTLPR多型と双極性障害の関連については、外国で関係があると報告されたものの、日本人の研究では関連はなく、結果は一致していません。注
本当は例外もあるのですが、全て説明すると頭が混乱しますので、この説明文の中では、例外は説明しないようにしました。
なぜCGアイランドでなく、CpGアイランドと呼ぶのでしょうか?
DNAは、互いに向き合った2本の鎖が結合した状態になっています。CはG、AはTとしかくっつかないので、2本のうち1本があれば、向かい合った鎖を複製することができます。
これが、親から子へ、細胞から細胞へ、遺伝情報を伝えることができる理由なのです。
さて、ここまで何度も出てきた「CG配列」というのは、2本鎖の中で向かい合ったCGではなくて、同じ1本の鎖の中で隣り合っているCGのことです。ですから、CはGとくっつきます、というルールとは全く関係ありません。なのに、ちょうど「CG」なので、誤解を招く可能性があります。そんなわけで、隣り合ったCとGを示す時には、両者の間にリン酸基(Phosphate)が挟まっている様子を表現して、「CpG」と呼ぶのです。
正確には、培養リンパ芽球由来です。 - ANK3
東アジア三ヶ国の共同研究により確認されたANK3と双極性障害の関連
ヒトのDNAは、アデニン(A)、シトシン(C)、グアニン(G)、チミン(T)の四種類の塩基から構成されていますが、その配列にはたくさんの個人差があります。それらのうち最も一般的なものが、一塩基多型(SNP
[スニップ]、single nucleotide
polymorphism)といわれるもので、この部分では塩基が一つだけ人によって異なっています(例えば、ある人ではAのところが、別の人ではCになっている)。これらSNPの一部は、さまざまな病気の発症リスクとも関連しうることが知られています。こういったSNPのうち、ある程度頻度が高いものを網羅的に調べ上げ、疾患に関連するSNPを探索する研究法のことを、ゲノムワイド関連解析(GWAS :
genome-wide association
study)といい、2005年頃から盛んに行われています。双極性障害も、過去の研究から一部遺伝的な影響を受けることが知られているため、2007年頃からGWASが行われてきました。そして、それらの中でも最大規模のGWAS(患者さん4387人、精神疾患に罹患していない対照群6209人を解析)によって同定された、最も有望な疾患感受性遺伝子候補の一つが、ANK3という遺伝子です。ただ、過去のGWASは殆どが白人を対象として行われたもので、はたしてANK3が日本人や他のアジア人でも双極性障害に関連しているかどうかは、明らかになっていませんでした。
そこで私たちは、ANK3遺伝子中の、2つのSNPについての関連解析を行いました。これら2つのSNPは、いずれも過去の白人での研究で、双極性障害との強い関連を認めたものです。
まず、全国の先生方のご協力によって収集された日本人の患者さん860名、精神疾患に罹患していない対照群の方々895名からご提供いただいたDNAサンプルを用いて解析を行いました。しかしながら、これらのSNPと双極性障害との有意な関連は認められませんでした。ただし、いずれのSNPでも、過去の研究で患者さんに多い塩基が、日本人でも多い傾向がみられました。一方、白人では患者さんに多い塩基をもっていると、そうでない人に比べて1.5倍ほど双極性障害にかかりやすいという結果だったのに対して、日本人では、その影響は1.1倍弱でしかありませんでした。
もし、これらのSNPが双極性障害と本当に関連しているとしても、1.1倍程度のリスクにしかならない場合には、非常に多くの方々のDNAを解析する必要があり、ここまでの研究に用いた検体数では十分とはいえません。そこで私たちは、韓国、台湾の先生方にもご協力いただき、韓国の患者さん352名と対照群の方々349名のデータ、台湾の患者さん1000人と対照群の方々1000人のデータを組み合わせて、複合的な解析(メタ解析)を行いました。研究に被験者として参加してくださった方々は、合計4456人にのぼりました。
その結果、2つのSNPのうち片方に、東アジア人でも有意な関連があることがわかりました。また日本人での結果と同様に、韓国人、台湾人でも、そのSNPが疾患のリスクに及ぼす影響は1.1倍程度でした。もう1つのSNPでは、各々の国での解析、メタ解析ともに関連を認めませんでした。白人では両方のSNPに関連があり、東アジア人では片方だけだったわけですが、この領域について詳しく調べると、遺伝子構造が白人と東アジア人、特に日本人と韓国人ではかなり異なっていることが分かり、これが結果に影響したと考えられました。
この研究によって、ANK3中のSNPのうち一つが人種を超えて双極性障害と関連すること、同じSNPでも、人種によって疾患のリスクに与える影響の強さが異なることが示唆されました。また、日本人だけを対象とした研究では疾患との関連が認められなかったのに対して、東アジアでの大規模な共同研究で関連が認められたことは、より規模の大きい研究を行うことの重要性を端的にあらわしています。さらに、GWASで調べられた頻度の高いSNPは、先行研究やこの研究からも示唆されるように、双極性障害のリスクに対して比較的弱い影響(1.1-1.5倍程度のリスク)しか及ぼさないことが明らかになってきており、もっと頻度の低いSNPの中に、より疾患リスクに強く影響するものがあるのではないかと考えられています。
しかしながら、対象とするSNPがまれになればなるほど、必要となる検体数は多くなります。また、そういったまれなSNPは、ある人種、ある地域の住民にしか存在しないということがしばしばあります。そのため、特定の遺伝的に均質な集団で、多数の検体を収集することの重要性が指摘されつつあります。そういった背景から、島国であり、鎖国を経験しているため均質な遺伝的背景をもち、また多く検体を収集するための人口を有する日本での大規模研究は、世界的にも期待されています。
Association of ANK3 with bipolar disorder confirmed in East Asia.
Takata A, Kim SH, Ozaki N, Iwata N, Kunugi H, Inada T, Ujike H, Nakamura K,
Mori N, Ahn YM, Joo EJ, Song JY, Kanba S, Yoshikawa T, Kim YS, Kato T.
Am J Med Genet B Neuropsychiatr Genet. 2011 Apr;156(3):312-5. - DNAメチル化の個人差
- メラトニン
- Xbp1
「小胞体」は細胞内小器官の一つで、細胞の中で作られた蛋白質の形を整えて、細胞膜内や細胞外でうまく働けるようにする役割を持っています。それに加え、傷ついた蛋白質が蓄積した時に、これを修復する役割も持っています。「小胞体ストレス」とは、小胞体の中に傷ついた蛋白質が蓄積して、小胞体にストレスがかかった状態を示しており、こうした場合に、傷ついた蛋白質を修復する蛋白質(シャペロン)を増やしたりする作用を、小胞体ストレス反応と呼んでいます。
これまで小胞体ストレス反応は、血流が不足するなど、病的な状態で生じると考えられてきました。私たちは以前、躁うつ病に小胞体ストレス反応の障害が関係するという説を提唱しましたが、脳内で小胞体ストレスがどのような生理的役割を持っているのかは謎でした。
当チームの林研究員らは、さまざまな神経科学の実験技術を用いて、小胞体ストレス反応における重要な分子であるXBP1が、神経栄養因子(BDNF)刺激により活性化すること、BDNFによる神経細胞の突起伸展にXBP1が必要がであることを明らかにしました。
BDNF刺激により、神経細胞の突起で活性化したXBP1は細胞核に移行し、神経突起の伸展に必要な遺伝子を増やす働きを持つと考えられ、XBP1が神経細胞の突起から細胞体へのシグナルとして働いていることがわかりました。
今回の成果は、小胞体ストレス反応が、病的な状態のみに見られる反応ではなく、正常な神経の発達と機能に重要な働きを持つことを示しています。
この成果により、今後、脳における小胞体ストレス反応の生理的意義とその病態の研究が更に加速すると期待されます。今回の成果は、Journal of
Biological Chemistryに掲載されました。Hayashi A, Kasahara T, Iwamoto K, Ishiwata M, Kametani M, Kakiuchi C,
Furuichi T, Kato T (2007) The role of BDNF-induced Xbp1 splicing during
brain development. Journal of Biological Chemistry. 282(47), 34525-34 (2007)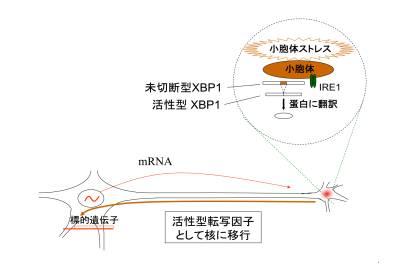
- 養育行動
-マウスの子育て開始には経験による細胞内ERK系の活性化が関与-
当チームの黒田公美研究員は、カナダ・マギル大学・ダグラス病院(マイケル・ミーニー教授ら)との共同研究により、マウスが子育てをしている時に視床下部・内側視索前野(※1)で働いている遺伝子を特定しました。特定された遺伝子は、ERK系*2と呼ばれる、記憶・学習などに必要な細胞内シグナルにかかわる分子群であり、この働きを止めると、子育て経験のないマウスは子育てが開始できなくなることがわかりました。この研究は、養育行動の神経メカニズムの解明の第一歩となりそうです。マウスなどの齧歯類の子育て行動は、かなりの部分「本能」によって行われると考えられてきました。
一方、FosBとよばれる、転写因子(遺伝子の働きを調節する分子)の遺伝子が欠損したマウスでは、養育行動ができなくなることから、FosB遺伝子が養育行動に必要だと考えられていましたが、FosBがどのように養育行動に関係しているのかは十分にわかっていませんでした。
黒田研究員は、養育しているマウスとしていないマウスの視床下部内側視索前野(MPOA)(※2)を比較することにより、養育行動時に働く分子群を特定しました。
これらの分子が全て、学習に応じて神経細胞同士のつながりを調節する働き(神経可塑性)に関与する、「ERK系」という細胞内シグナル伝達に働く分子であったことから、この経路を薬で阻害する実験を行いました。その結果、既に十分養育経験を積んだマウスでは、ERK系を阻害しても養育行動は影響されませんでしたが、出産経験のないマウスは、ERK系を阻害すると、仔を与えても養育行動を開始できなくなることがわかりました。
これらのことから、養育行動の開始には、仔からうける知覚入力により、視床下部MPOAで記憶・学習の際と同じような神経ネットワークの変化が起きることが必要であることが示唆されます。
今回得られた知見は、本能のみで子育てができると考えられてきたマウス(※3)でさえも、仔と接する経験により神経ネットワークが変化していくことが重要な役割を果たすことが示唆されました。
こうした研究が更に進むことにより、将来的には、養育行動の障害(虐待など)のメカニズムの解明にも手がかりを与えると期待されます。
本研究成果は、米国の科学雑誌『Molecular and Cellular Neuroscience』(2007年10月号)(※4)に発表されました。

図1 養育しているマウスとしていないマウス
左が養育しているマウス。巣を作り、仔を集めている。
右が養育していないマウス。巣を作らず、仔がばらばらになっている。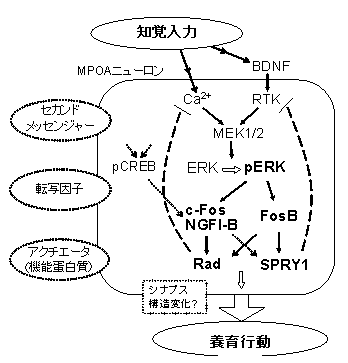
図2 視床下部内側視索前野におけるERK系の図。太字で示した分子が、仔を見せることにより変化していた。
補足説明
- 視床下部 内側視索前野視床下部は、脳の中心部にあり、ホルモンをコントロールしたり、食欲、睡眠、性行動など、いわゆる本能的な行動に関係している脳部位です。中でも内側視索前野(とくに背外側部)は、この部分を破壊すると養育行動が消失すること、養育行動時にこの部位が活性化することから、養育行動にとって重要な脳部位と考えられてきました。
- ERK系Extracellular signal regulated
kinase(細胞外シグナルにより制御されるリン酸化酵素)の略。神経細胞がさまざまな刺激を受けるとリン酸化され、その細胞の遺伝子発現を変化させます。
このシグナル系は、シナプス部分の形が変化したり、神経細胞の突起が伸びて新たなシナプスができるなど、神経ネットワークが環境に応じて変化する際に必要であり、脳が環境から学習したり、記憶したりする働きに関係していると考えられます。 - 本能のみで養育行動ができると考えられてきたマウスに比べ、霊長類の養育行動には、さらに環境が大きく影響すると考えられています。
- Kuroda KO, Meaney MJ, Uetani N, Fortin Y, Ponton A, Kato T. ERK-FosB
signaling in dorsal MPOA neurons plays a major role in the
initiation of parental behavior in mice. Mol Cell Neurosci. 2007
Oct;36(2):121-31.
- mtDNAの個人差
- 躁うつ病モデルマウス
- ピロロキノリンキノン
2003年、私たちは、双極性障害に関わる遺伝子を探索する過程で、未知の遺伝子を発見しました。
バイオインフォーマティクス解析や生化学的分析などにより、この遺伝子はPQQを酸化還元補酵素とする酵素をコードしていると考えられました(Kasahara &
Kato, Nature
2003)。すでにマウスやラットではPQQ欠乏症が報告されており、PQQを利用する重要な酵素が初めて見つかったことから、ほ乳類にとってPQQはビタミンであろうと私たちは発表しました。その後、他の研究者より、私たちの解釈に対する異議もあり(Felton & Anthony, Nature 2004; Rucker et al,
Nature 2004)、私たちもそれに対して返答しましたが(Kasahara & Kato Nature
2004)、やはり、人で欠乏症があるのかどうかはっきりしない点において、人においてもビタミンと言えるかどうかは、まだわかりません。とはいえ、PQQがさまざまな重要な生理活性を持つビタミン様物質であることに意義を唱える人はいません。PQQの役割をさらに解明すべく、期間限定で理化学研究所の「理事長ファンド」の支援を受け、学際的な共同研究チームが結成され、PQQの新たな定量分析法が開発されると共に(Noji
et al, J. Agric. Food Chem.
2007)、植物に環境ストレス耐性を与える(例えば、塩害に強い生育を可能にする)という重要な生理活性が発見されました(http://www.wipo.int/patentscope/search/en/WO2006059782)。しかしながら、人における欠乏症の有無を検証するために、人由来試料でPQQを測定が必須であり、そのためにはさらなる技術革新が必要だということもわかりました。現在、私たちは双極性障害の研究に専念していますが、今後、新たな技術革新や精神疾患との関連を示唆する新たな事実などが現れた折には、ぜひまたPQQの研究にも取り組んでみたいと思っています。
インタビュー/記事
- うつ状態を繰り返すモデルマウスで双極性障害の原因が見えてきた
- BSI主催 第1回代官山蔦屋書店で脳科学∞つながる 作家・絲山秋子×加藤忠史
- Minding the brain in bipolar disorder(RIKEN
RESEARCH)(2015年7月17日)[英語] - ビデオインタビュー 「うつ病研究の現状と課題」(うつ病・認知症コンソーシアム)
- この10年の成果(2010年9月)
- 2019一般公開
- 躁うつ病の克服に挑む(RIKEN NEWS)(2006年10月)
